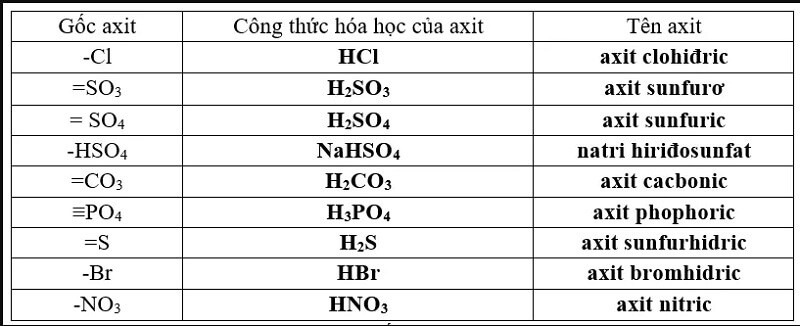
Thế nào là gốc axit mạnh?

Thế nào là gốc axit mạnh?
Axit là phân tử hóa học bao gồm nguyên tử hidro và gốc axit. Khi tách nguyên tử hidro ra khỏi phân tử hóa học thu được gốc axit. Ví dụ:
-
Axit Clorua HCl khi tách nguyên tử hidro => thu được gốc axit Cl-
-
Axit Nitric HNO3 khi tách nguyên tử hidro => thu được gốc axit NO3-
-
Axit Sunfuric H2SO4 khi tách nguyên tử hidro => thu được gốc axit SO42- hoặc H2SO4-
Gốc axit mạnh hay yếu phụ thuộc vào axit mạnh hay yếu. Gốc axit mạnh hiểu đơn giản là gốc axit tách từ axit mạnh. Trên thực tế gốc axit tồn tại ở rất nhiều nơi như nước uống hàng ngày, các loại thực phẩm, các loại hoa quả…
Hướng dẫn cách xác định gốc axit mạnh và yếu
Hướng dẫn cách xác định gốc axit mạnh và yếu
Để xác định gốc axit mạnh và yếu chúng ta sử dụng cách so sánh định tính tính axit của các axit hoặc so sánh định lượng tính axit của axit. Cách xác định gốc axit mạnh và yếu được thực hiện như sau:
Xác định axit mạnh và yếu theo so sánh định tính axit của các axit
-
Nguyên tắc chung: Nguyên tử hidro càng linh động tình tính axit của gốc axit càng mạnh
-
Các axit có oxi của cùng 1 nguyên tố: Axit càng nhiều oxi tính axit càng mạnh. Ví dụ HClO < HClO2 < HClO3
-
Axit của nguyên tố cùng chu kì: Axit có nguyên tố trung tâm có tính phi kim càng mạnh thì càng mạnh (trong đó các nguyên tố đều ở mức hóa trị cao nhất). Ví dụ H3PO4 < H2SO4 < HClO4
-
Axit của các nguyên tố trong cùng nhóm A:
Axit không có oxi: Các axit có oxi tính axit tăng dần từ trên xuống dưới. Ví dụ HF < HCl < HBr < HI (do bán kính ion X- tăng)
Axit có oxi: Các axit có oxi tính axit tăng dần từ dưới lên trên. Ví dụ: HIO4 < HBrO4 < HClO4 (do độ âm điện của X giảm dần)
Nếu gốc R no (đẩy e) làm giảm tính axit, gốc R no càng nhiều nguyên tử C thì đẩy e càng mạnh. Ví dụ: HCOOH > CH3COOH > CH3CH2COOH > n-C4H9COOH
Nếu gốc R hút e (gốc R thơm hoặc có halogen, không no…) sẽ tăng tính axit
Gốc R chứa nguyên tử halogen:
Ví dụ: CH2FCOOH > CH2ClCOOH > CH2BrCOOH > CH3COOH
Ví dụ: Cl3CCOOH > ClCH2COOH > CH3COOH
Ví dụ: CH3CH2CHClCOOH > CH3CHClCH2COOH > CH2ClCH2CH2COOH > CH3CH2CH2COOH
-
Độ mạnh yếu của cặp axit/ bazơ liên hợp: Tính axit càng yếu thì bazơ liên hợp càng mạnh và ngược lại
-
Xét tính mạnh yếu của axit với một phản ứng: Axit mạnh đẩy được axit yếu khỏi dung dịch muối (trừ 1 số trường hợp đặc biệt)
Xác định axit mạnh, yếu theo so sánh định lượng axit của các axit
So sánh định lượng tính axit của các axit với axit HX trong nước có cân bằng:
HX ⇔ H+ + X- ta có hằng số phân li axit KA
Trong đó KA phụ thuộc vào bản chất của axit, nhiệt độ. Giá trị KA càng lớn thì tính axit của axit càng mạnh.
Như vậy:
-
Axit yếu phân li 1 phần thành ion của chúng trong nước, axit mạnh phân li hoàn toàn
-
Các axit mạnh là axit clohydric, axit sunfuric, axit hydrobromic, axit nitric, axit hydroiodic, axit citric, axit pecloric, tất cả các axit còn lại là axit yếu
-
Axit yếu duy nhất được tạo thành do phản ứng giữa halogen và hydro là axit flohydric - HF. Tron khi về mặt kỹ thuật HF cực kỳ mạnh và có tính ăn mòn cao
Gốc axit mạnh có những tính chất điển hình nào?

Gốc axit mạnh có những tính chất điển hình nào?
Các gốc axit mạnh có những tính chất điển hình là:
-
Đổi màu quỳ tím thành đỏ
-
Phản ứng với muối, bazơ, oxit bazơ, kim loại (axit loãng, kim loại đứng trước hidro trong dãy hoạt động hóa học)
2Na + 2HCl → 2NaCl + H2
2Fe + 6H2SO4 → 3SO2 + Fe2(SO4)3 + 6H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2+ 2H2O
Na2O + 2HCl → 2NaCl + H2
CuO + 2HCl → CuCl2 + H2O
K2CO3 + 2HCl → 2KCl + H2O + CO2 (H2CO3 phân hủy ra H2O và CO2)
5 gốc axit mạnh thường gặp nhất hiện nay
Các gốc axit mạnh có thể kể đến là (SO4)2-, (NO3)-, ClO4-... Dưới đây là giới thiệu về 5 gốc axit thường gặp nhất hiện nay.
Gốc (SO4)2-
Gốc (SO4)2- (gốc sunfat) của Axit Sunfuric có công thức hóa học là H2SO4 là axit vô cơ mạnh quen thuộc. Loại axit rất nguy hiểm có khả năng ăn mòn nhiều kim loại như nhôm, sắt… ngay cả khi chúng bị pha loãng. Khi thực hiện pha loãng H2SO4 cần trang bị đầy đủ bảo hộ như tấm bảo vệ, găng tay, quần áo, tạp dề PVC. Thao tác pha loãng cần cho từ từ H2SO4 vào nước và khuấy đều, tuyệt đối chú ý không làm ngược lại.
Gốc (NO3)-
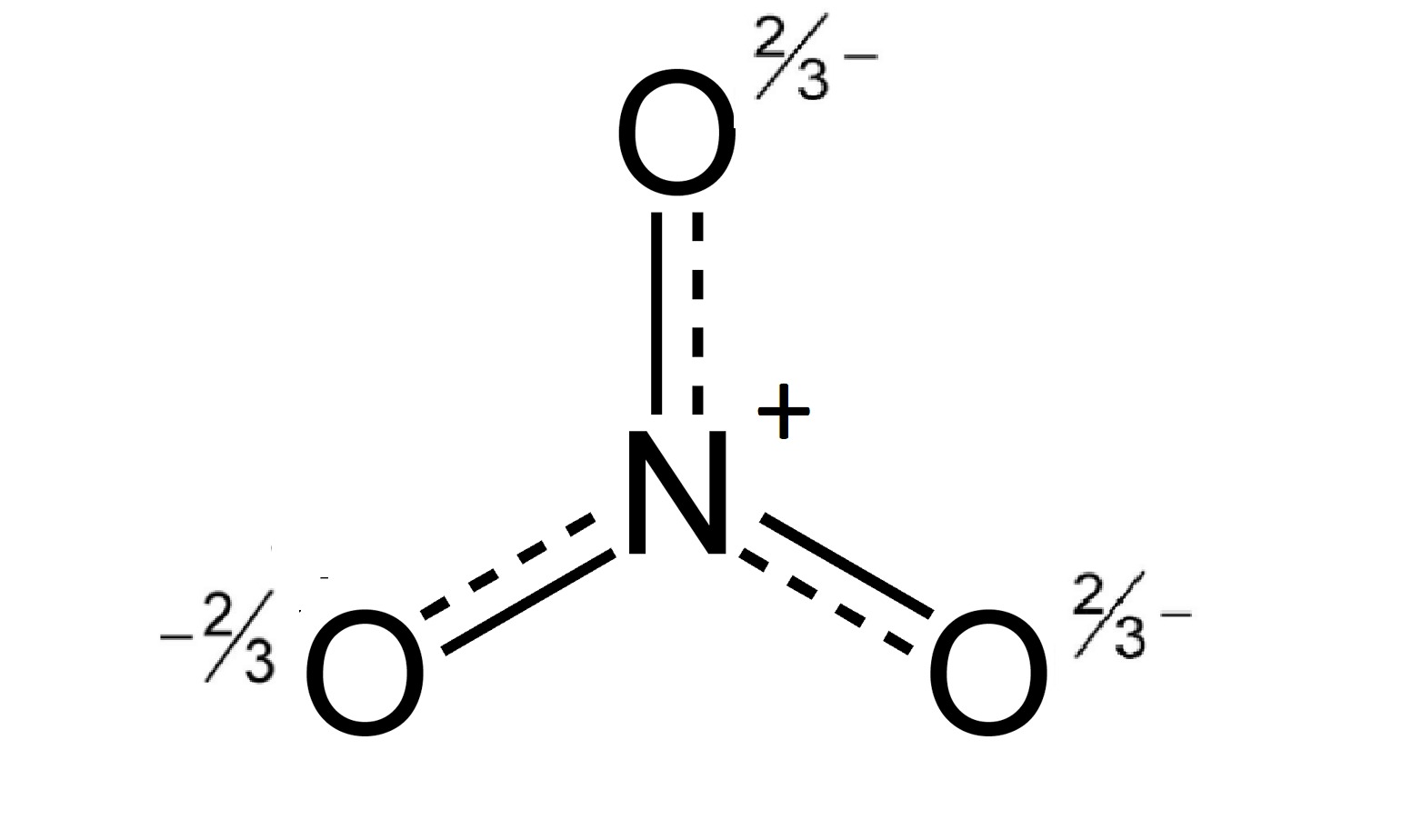
Gốc axit (NO3)-
Gốc NO3- (gốc nitrat) là của axit nitric HNO3, là chất độc có khả năng ăn mòn mạnh, dễ gây cháy. Loại axit này không màu, nếu để lâu sẽ tích tụ nitơ thành màu hơi vàng.
Gốc Cl-
Gốc Cl- (clorua) là gốc của axit vô cơ mạnh được tạo ra từ sự hòa tan của khí hydro trong nước tạo thành axit HCl (axit clohydric). Axit HCL có nồng độ tối đa là 40%, đây là dạng đậm đặc và có thể tạo thành dạng sương mù. HCl nguy hiểm và có thể gây ăn mòn mô, tổn thương cơ quan hô hấp, da, mắt, ruột… Khi ở dạng loãng axit này được sử dụng làm chất tẩy rửa, vệ sinh, lau chùi nhà cửa
Gốc Br-
Gốc Br- có tên gọi là bromua là gốc axit của axit bromhidric HBr. Đây là axit vô cơ mạnh phổ biến được sử dụng nhiều trong phòng thí nghiệm, là thành phần chủ yếu sản xuất ra muối bromide. Axit có tính ăn mòn, không bắt lửa, tan tốt trong nước tồn tại dưới dạng chất lỏng trong suốt không màu.
Gốc ClO4-
ClO4- là gốc axit của axit percloric HClO4, axit thường được dùng để điều chế các muối perchlorat. Axit percloric là 1 axit rất mạnh, chất oxi hóa mạnh dễ tan trong nước, ở dạng dung dịch nước, không màu, không mùi, ăn mòn kim loại và mô. Axit percloric được sử dụng để phân hủy các quặng phức tạp, làm chất xúc tác, phân tích khoáng vật.
Giải đáp một số thắc mắc về gốc axit
Các gốc axit đóng vai trò quan trọng trong nhiều phản ứng hóa học. Xác định gốc axit mạnh hay yếu là thắc mắc chung của nhiều người. Chúng ta cùng xem xét câu trả lời của một số câu hỏi về các gốc axit dưới đây nhé.
CO3 là gốc axit mạnh hay yếu?

CO3 là gốc axit mạnh hay yếu?
CO3 được gọi là carbonat là gốc axit yếu, vì có khả năng nhận thêm proton (H+) để tạo thành axit yếu HCO3- (hydrocarbonat), H2CO3 (axit cacbonic), khi kết hợp với cation tạo thành muối cacbonat. CO3 trong nước có khả năng tạo thành các ion hydroxit và cacbonat. Khối lượng axit hiếu trong muối cacbonat khá nhỏ.
NO3 là gốc axit mạnh hay yếu?
NO3 (nitrat) là gốc axit mạnh của axit nitric HNO3, đây là axit mạnh thường được sử dụng trong công nghiệp để sản xuất thuốc nhuộm, tẩy trắng, chất nổ, phân bón, chế biến thủy tinh… HNO3 còn được sử dụng trong nhiều quá trình hóa học khác nhau.
H2SO4 là gốc axit mạnh hay yếu?
H2SO4 (axit sunfuric) là axit mạnh quan trọng nhất, được ứng dụng nhiều trong công nghiệp, sử dụng để sản xuất phân bón, chất chữa cháy, tạp pin và làm sạch kim loại…
Địa chỉ cung cấp axit mạnh HCl trên toàn quốc
Axit mạnh HCl là hóa chất khá nguy hiểm nên để hạn chế rủi ro liên quan đến chất lượng, khách hàng nên chọn mua tại các đơn vị cung cấp uy tín. Công ty cổ phần Đông Á là đơn vị hàng đầu chuyên phân phối các sản phẩm hóa chất hàng đầu tại Việt Nam. Đơn vị cam kết cung cấp sản phẩm có giá thành hợp lý, chất lượng với đầy đủ giấy tờ chứng nhận. Hãy liên hệ với chúng tôi 0822 525 525 để nhận tư vấn nhiệt tình 24/7 từ đội ngũ nhân viên chuyên nghiệp.
Trên đây là thông tin chi tiết về gốc axit mạnh và giới thiệu về 5 loại thường gặp nhất. Hy vọng nội dung này sẽ hữu ích cho các bạn đang cần tìm kiếm thông tin.