Amoniac NH3 là gì?

Khái quát về amoniac là gì?
Amoniac là tên gọi được phiên dịch ra tiếng Việt từ cụm từ ammoniac trong tiếng Pháp.
Amoniac là chất gì? Amoniac là một hợp chất vô cơ được tạo bởi 3 nguyên tử nitơ và 1 nguyên tử hydro tạo thành 1 liên kết kém bền. Công thức hóa học của amoniac chính là NH3.
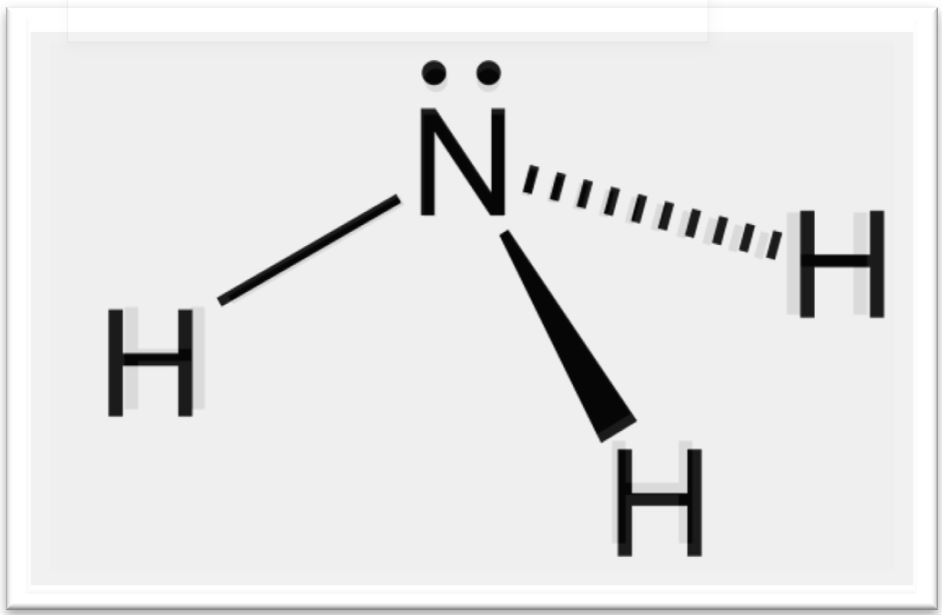
NH3 có cấu tạo phân tử là hình chóp, nguyên tử nitơ ở đỉnh liên kết cộng hóa trị với 3 nguyên tố hidro ở đáy tam giác (N có điện tích âm, H có điện tích dương, cả 3 liên kết N-H đều là liên kết cộng hóa trị có phân cực).
Amoniac có ở đâu? Amoniac được sinh ra nhiều ở trong tự nhiên, thận của cơ thể con người chúng ta cũng sản sinh ra một lượng nhỏ khí NH3, vì vậy nên nước tiểu cũng có mùi khai đặc trưng giống với khí amoniac. Khí amoniac cũng được hình thành qua quá trình phân hủy xác động vật dưới tác động của vi sinh vật.
Vậy khí amoniac có độc không? Ở điều kiện tiêu chuẩn thì amoniac là một khí độc. Cần lưu ý nếu hít phải, nuốt phải hoặc tiếp xúc trực tiếp amoniac có nồng độ đậm đặc cao có thể xảy ra hiện tượng nhiễm độc amoniac, gây nguy hiểm đến tính mạng con người thậm chí là tử vong. Ở dạng dung dịch NH4OH thì amoniac là một dung dịch bazơ yếu, được phân hủy thành khí NH3 và nước.
Mùi amoniac là mùi hăng, khai đặc trưng, có thể được nhận biết trong thành phần nước tiểu động vật. Bởi trong quá trình chuyển hóa thức ăn, cơ thể bài tiết ra một lượng nitơ trong đạm và kết hợp với các chất hữu cơ khác dễ sinh ra khí NH3. Cách khử mùi amoniac là có thể dùng baking soda hay giấm ăn có thành phần axit axetic.
Amoniac sôi ở nhiệt độ -33,34 độ C ở áp suất của bầu khí quyển, do đó nên hóa chất được bảo quản dưới áp suất hoặc trong nhiệt độ thấp. Amoniac đóng băng ở nhiệt độ -77,7 độ C và cho tinh thể màu trắng.
Amoniac lỏng công nghiệp thường là 28% NH3 trong nước, được chứa trong bồn bông, vận chuyển bằng xe tô tô hay bình chứa.
Tính chất vật lý, tính chất hóa học amoniac là gì?
Tính chất vật lý, tính chất hóa học amoniac là gì?
Mỗi loại hóa chất sẽ mang trong mình những tính chất khác nhau
Tính chất vật lý của amoniac NH3 là:
Amoniac thông thường tồn tại ở dạng khí, không màu và có mùi hôi hơi khó chịu. Amoniac có thể gây chết người nếu có nồng độ lớn. Amoniac có mật độ gấp 0,589 lần không khí, và nhẹ hơn không khí.
Vì phân tử NH3 có cặp electron tự do, và liên kết N-H bị phân cực nên amoniac có độ phân cực lớn, từ đó thì amoniac cũng là chất dễ bị hóa lỏng.
Dung dịch amoniac là một dung môi hòa tan tốt. NH3 có hằng số điện môi nhỏ hơn nước nên hòa tan các dung môi hữu cơ dễ hơn nước. NH3 lỏng có thể hòa tan kim loại kiềm và các kim loại như Sr, Ca, Br tạo ra dung dịch xanh thẫm.
Khối lượng của một phân tử NH3 tại áp suất tiêu chuẩn 1atm là 0.769 kg/m3, với tỷ lệ giãn nở thể tích 850 đến 1000 lần. Ở nhiệt độ -33 độ C, NH3 có khối lượng riêng là 681 kg/m3.
Amoniac hòa tan 47% ở nhiệt độ 0 độ C (89,0 g/100ml), hòa tan 31%ở 25 độ C, hòa tan 18% ở nhiệt độ 50 độ C.
Dung dịch amoniac có độ pH lớn hơn 12 vì có tính bazơ.
Dung dịch amoniac sôi ở điểm sôi 33,34 độ C, có điểm nóng chảy là -77,7 độ C, NH3 khí có nhiệt độ tự cháy là 650 độ C.
Tính chất hóa học của amoniac NH3 là:
Dung dịch NH3 là một hợp chất có tính bazơ kém bền, nên nó mang đầy đủ tính chất hóa học của một bazơ yếu.
NH3 tan trong nước sẽ tạo thành cation amoni NH4+, giải phóng anion OH- theo phương trình phản ứng dạng phân tử sau:
NH3 + H2O -> NH4+ + OH-
NH3 có tính bazơ yếu, nên sẽ làm quỳ tím chuyển xanh, phenolphtalein không màu chuyển thành màu đỏ khi tác dụng với chất chỉ thị màu.
Amoniac có thể bị phân hủy ở nhiệt độ cao nên kém bền
2NH3 -> N2 + 3H2N2 + 3H3 -> 2NH3
NH3 tác dụng được với kim loại chuyển tiếp tạo ra ion phức theo phương trình
2NH3 + Ag+ -> (Ag(NH3)2)+
Amoniac còn có tính khử, nguyên tử hidro trong amoniac có thể bị thay thế bởi nguyên tử kim loại kiềm
2NH3 + 2Na -> 2NaNH2 + H2
2NH3 + 2Al -> 2AlN + 3H2
Amoniac tạo ra muối amoni khi tác dụng với axit
NH3 + H+ -> NH4+
NH3 có khả năng tạo ra kết tủa nhiều hidroxit kim loại khi tác dụng với dung dịch muối.
Cách sản xuất, điều chế ra amoniac NH3

Cách sản xuất, điều chế ra amoniac NH3
Amoniac có thể được điều chế cả trong phòng thí nghiệm và trong công nghiệp
Để điều chế amoniac trong phòng thí nghiệm có thể làm như sau:
Dùng muối NH4Cl tác dụng với nước vôi trong Ca(OH)2, sinh ra khí NH3
2NH4Cl + Ca(OH)2 -> NH3 (khí) + CaCl2 + H2 (khí)
Cách điều chế sản xuất amoniac trong công nghiệp
Chủ yếu theo phương thức Haber - Bosch với phản ứng hai chiều liên tiếp xảy ra
CH4 + H2O <-> CO + 3H2 (nhiệt độ cao, xúc tác Ni)
N2 + 3H2 <-> 2NH3 (*tam giác*H = -92 kJ/mol)
Ngoài ra người ra còn có thể dùng các công nghệ phổ biến khác như: công nghệ M.W.Kellogg, công nghệ Haldor Topsoe, công nghệ Krupp Uhde, công nghệ ICI hay công nghệ Brown & Root để sản xuất amoniac. Trong số đó công nghệ để sản xuất NH3 được áp dụng nhiều nhất bởi các nhà máy phân đạm tại Việt Nam là công nghệ Haldor Topsoe.
Amoniac trong công nghiệp được bán dưới dạng khí hóa lỏng NH3 và dung dịch amoniac NH4OH, đều được vận chuyển trong ống trụ hoặc xe bồn.
Do ở dạng đậm đặc amoniac rất nguy hiểm và có tính ăn mòn nên yêu cầu về sản xuất, lưu trữ amoniac đều phải tuân thủ theo các quy trình nghiêm ngặt.
Những ứng dụng của NH3 amoniac là gì?

Những ứng dụng của NH3 amoniac là gì?
Ứng dụng của amoniac trong đời sống và công nghiệp rất rộng rãi. Sau đây là vài ví dụ điển hình về ứng dụng NH3
-
Ứng dụng NH3 làm phân bón: Vì các hợp chất nitơ đều có nguồn gốc từNH3, rất cần thiết cho sự phát triển của cây trồng nên trên thực tế có khoảng 83% NH3 lỏng được dùng để làm phân bón.
-
Trong nhiều gia đình amoniac dạng dung dịch còn được dùng làm chất tẩy rửa cho các bề mặt như lò nướng, thủy tinh, đồ sứ và thép không gỉ, NH3 lỏng sẽ tạo ra ánh sáng rực rỡ.
-
Trong ngành dệt may thì amoniac lỏng được dùng để điều trị nguyên liệu bông, cung cấp cho tài sản kiềm bóng sử dụng chất kiềm.
-
NH3 là chất khử mạnh nên NH3 còn đang được sử dụng làm chất chống khuẩn trong thực phẩm với mục đích thương mại để loại bỏ nhiễm khuẩn trong thịt bò, amoniac còn có tác dụng điều chỉnh độ chua.
-
Amoniac còn có thể giúp cho màu sắc của đồ gỗ được chế biến đậm hơn vì khí NH3 có phản ứng với tanin tự nhiên trong gỗ.
-
NH3 còn được dùng để khai thác kim loại như niken và molypden từ các loại quặng, ngoài ra còn dùng để trung hòa axit, thành phần của dầu thô và bảo vệ các thiết bị tránh bị ăn mòn.
-
NH3 còn được dùng trong xử lý môi trường với mục đích loại bỏ các chất như sox, nox trong khí thải khí đốt nguyên liệu hóa thạch như đá, than,...
Thông qua bài viết trên đây của Hóa chất Đông Á, có lẽ các bạn đã nắm được khái quát amoniac là gì và nó được ứng rộng rãi trong cuộc sống của chúng ta như thế nào. Tuy có mang lại một số nguy hiểm nhất định nhưng không thể phủ nhận NH3 vẫn có công dụng rất lớn đối với công nghiệp và đời sống.